सांद्रता किसे कहते हैं? सांद्रता की परिभाषा, सूत्र और इसका मात्रक क्या है?

स्वागत हैं दोस्तों आपका हमारी हिंदी केमिस्ट्री की वेवसाइट पर। आज हम आपको सांद्रता किसे कहते हैं? सांद्रता की परिभाषा क्या होती है? सांद्रता का सूत्र क्या होता है? और सांद्रता का मात्रक क्या होता है? इस सबके बारे में बताएँगे। पिछले आर्तिक्ल में हमने आपको परासरण किसे कहते हैं? परासरण की परिभाषा क्या होती है? परासरण कितने प्रकार का होता है? परासरण के उपयोग तथा परासरण के उदाहरण के बारे में बताया। इस आर्टिकल में हम आपको सांद्रता किसे कहते हैं विस्तार के साथ बताएँगे। इसके साथ सांद्रता से जुड़ी और भी बहुत सी जानकारी आपको देंगे।
सांद्रता एक बहुत महतवपूर्ण टॉपिक है। यह टॉपिक परीक्षा की दृष्टी से भी बहुत महतवपूर्ण है। परीक्षाओं में सांद्रता के कई प्रश्न आ जाते हैं। जिसका उत्तर देना हमारे लिए जरूरी होता है।इस टॉपिक को हम बहुत आसान शब्दों में विस्तार के साथ बताएँगे, इसलिए इस महत्वपूर्ण टॉपिक को ध्यानपूर्वक पढ़े ताकि आप को ज्यादा लम्बे समय तक याद रह सके। आज के इस आर्टिकल में हम आपको विलयन की सांद्रता के बारे में भी बताएँगे। और साथ ही साथ विलयन की सांद्रता का प्रभाव कहाँ पर अधिक होता है? व विलेय पदार्थ और विलायक किसे कहते हैं यह भी बताएँगे।
विलयन की सांद्रता किसे कहते हैं?
दोस्तों यह प्रश्न अधिकतर परिक्षाओं में पूँछ लिया जाता है कि विलयन की सांद्रता किसे कहते हैं? विलयन की सांद्रता को जानने के लिए हमें सबसे पहले विलयन के बारे में पता होना चाहिए कि विलयन किसे कहते हैं? विलयन किन चीजो से मिलकर बनता है? आइए जानते हैं विलयन के बारे में।
विलयन (Solution)
- दो या दो से अधिक समांगी मिश्रण को विलयन कहते हैं। अथवा विलेय और विलायक के मिश्रण को विलयन कहते हैं।
- समांगी मिश्रण(विलयन) में प्रत्येक भाग का संघटन सामान होता है।
- दो पदार्थों से मिलकर बने विलयन को द्विअंगी विलयन तथा तीन पदार्थों से मिलकर बने विलयन को त्रिअंगी विलयन कहते हैं।
उदाहरण- पानी और नमक का घोल, पानी और चीनी का मिश्रण, एल्कोहल और जल का समांगी मिश्रण, अमोनिया और जल का मिश्रण।

विलेय तथा विलायक (Solute and Solvent)
सांद्रता के बारे में जानने से पहले सांद्रता किसे कहते हैं? ये जानने से पहले हमें विलेय तथा विलायक के बारे में जरूर पता होना चाहिए। समांगी मिश्रण में जो अवयव अधिक मात्रा में उपस्थित होता है उसे विलायक तथा जो अवयव जो अवयव कम मात्रा में उपस्थित होता है उसे विलेय कहते हैं। अगर हम सांद्रता के पद से विलेय विलायक के बारे में जाने तो वह पदार्थ जो विलयन में कम मात्रा में उपस्थित हों विलय कहलाता है तथा वह पदार्थ जो विलयन में अधिक मात्रा में उपस्थित हो विलेय कहलाता है।
सांद्र विलयन (Concentrate Solution) किसे कहते हैं?
वह विलयन जिसमें विलेय की सांद्रता विलायक की सांद्रता से अधिक होती है, उसे सांद्र विलयन कहते हैं। जब विलेय और विलायक आपस में मिलते हैं और मिलकर जो विलयन बनाते है उस विलयन के गाड़े पन को सांद्रता कहते हैं। जो विलयन जितना गाढ़ा होगा उस विलयन की सांद्रता उतनी ही अधिक होगी। अथवा विलयन में उपस्थित विलेय पदार्थ की मात्रा को सांद्रता कहते हैं।

सांद्रता व्यक्त करने की विधियाँ
सांद्रता व्यक्त करने की विधियाँ निम्नलिखित हैं-
1. द्रव्यमान प्रतिशत (mass percentage w/w) – किसी विलयन के 100 ग्राम में घुली विलेय की मात्रा को उस विलयन का द्रव्यमान प्रतिशत कहते हैं। इसे W/W% से व्यक्त करते हैं।
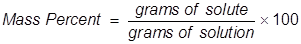
उदाहरण – NaCl के जलीय विलयन का द्रव्यमान प्रतिशत 10% (W/W) है इसका अर्थ है कि 100gm विलयन में 10gm NaCl उपस्थित है।
2. आयतन प्रतिशत (volume percentage V/v) – किसी विलयन के 100ml आयतन में उपस्थित विलेय के ml में आयतन की मात्रा विलयन का आयतन प्रतिशत कहलाती है। इसे V/V% से व्यक्त करते हैं।

3. प्रतिशत सांद्रता (mass by volume percentage W/V) – किसी विलयन के 100ml में उपस्थित विलेय की ग्राम में मात्रा प्रतिशत सांद्रता कहलाती है। इसे W/V% से व्यक्त करते हैं।

उदाहरण – NaCl के जलीय विलयन की प्रतिशत सांद्रता 10% (W/V) है इसका अर्थ है 100 ml NaCl के विलयन में 10gm NaCl उपस्थित है।
4. मोलरता (Molarity) – किसी विलयन के एक लीटर में उपस्थित विलेय पदार्थ के मोलो की संख्या विलयन की मोलरता कहलाती है इसे M से प्रदर्शित करते हैं।
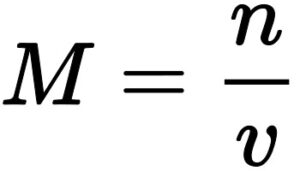
M = मोलरता
n = विलेय के मोलो की संख्या
v = विलयन का आयतन (लीटर में)
5. नॉर्मलता (Normality) – किसी विलयन के एक लीटर में उपस्थित विलेय पदार्थ के मिली तुल्यांको की संख्या विलयन की नॉर्मलता कहलाती है। इसे N से प्रदर्शित करते हैं।
![]()
6. मोललता (Molality) – किसी विलायक के एक किलो ग्राम में उपस्थित विलेय के मोलो की संख्या विलयन की मोललता कहलाती है। इसे m से प्रदर्शित करते हैं।
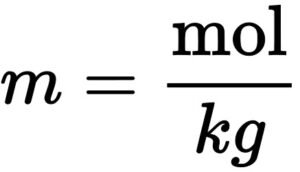
m = मोललता
mol = विलेय के मोलो की संख्या
kg = विलायक का भार किलो ग्राम में
7. मोल अंश या मोल प्रभाज – किसी विलयन में उपस्थित विलेय या विलायक के मोलो की संख्या तथा विलेय या विलायक के कुल मोलो की संख्या का अनुपात विलेय या विलायक का मोल प्रभाज कहलाता है।

8. विलयन की ग्राम/लीटर में सांद्रता – किसी विलयन के एक लीटर में उपस्थित विलेय की ग्राम में मात्रा विलयन की ग्राम/लीटर में सांद्रता कहलाती है। उदाहरण के लिए ग्लूकोस के विलयन की सांद्रता 10 gm/लीटर है इसका अर्थ है 1 लीटर ग्लूकोस विलयन में 10 gm ग्लूकोस घुला है।
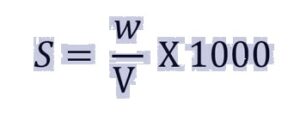
S = सांद्रता (ग्राम/लीटर)
w = विलेय का भार (ग्राम)
V = विलयन का आयतन (ml)
9. PPM (Parts Per Million) – किसी विलयन में विलेय की अतिसूक्ष्म मात्रा उपस्थित होने पर उसकी सांद्रता को PPM में व्यक्त करते हैं। किसी विलयन के 1 million (10 lakh) ग्राम में उपस्थित विलेय की ग्राम में मात्रा विलयन की PPM में सांद्रता कहलाती है।

10. फॉर्मलता (Formalty) – किसी विलयन के 1 लीटर आयतन में उपस्थित विलेय के सूत्र बहारों की संख्या विलयन की फॉर्मलता कहलाती है। इसे F से व्यक्त करते हैं।

प्रश्न- उस विलयन की मोलरता की गणना कीजिए जिसमें 5 ग्राम NaOH , 450 ml विलयन में घुला हो?
हल- मोलरता (M) = ?
NaOH का भार =5 ग्राम
NaOH का अणुभार = 23+16+1 =40
विलयन का आयतन = 450 ml
मोलरता = NaOH का भारx1000 / NaOH का अणुभारx विलयन का आयतन (ml)
मोलरता = 5×1000/40x 450
उत्तर – मोलरता =5/18 = 0.28 मोल/लीटर
निष्कर्ष
दोस्तों आज के इस आर्टिकल में हमने आपको सांद्रता किसे कहते हैं? विलयन किसे कहते हैं?, विलायक किसे कहते हैं? और सांद्रता व्यक्त करने की विधियाँ जैसे- आयतन प्रतिशत(V/V), द्रव्यमान प्रतिशत(W/W ), प्रतिशत सांद्रता(W/V), ग्राम/लीटर, मोलरता (Molarity), नॉर्मलता (Normality), मोललता (molality), PPM (Parts Per Million), फॉर्मलता (Formality), मोल प्रभाज(Mole Fraction) के बारे में विस्तार के साथ बताया है, इनके सूत्रों को भी हमने इस आर्टिकल में दर्शाया है। इसी तरह की केमिस्ट्री से सम्बंधित जानकारी हम इस हिंदी केमिस्ट्री की वेवसाइट पर देते रहते हैं। और अधिक जानकारी पाने के लिए जुड़े रहिए हमारे साथ तब तक के लिए धन्यवाद।




