नार्मलता किसे कहते हैं इसकी परिभाषा और सूत्र क्या है?

तो कैसे हैं आप लोग? आपका बहुत बहुत स्वागत है हमारे इस हिंदी केमिस्ट्री की वेबसाइट पर। हम आपके लिए दिन प्रतिदिन रसायन विज्ञान के नए नए लेख लेकर आते रहते हैं। उसी क्रम में आज हम आपके लिए एक और नया लेख लेकर आए हैं जिसका नाम है नार्मलता किसे कहते हैं? सांद्रता ओं को व्यक्त करने के लिए रसायन विज्ञान में विभिन्न प्रकार के मानक बनाए गए हैं। उन्हीं में से नॉर्मलता एक प्रकार का मानक है जिसकी सहायता से सांद्रता को व्यक्त किया जाता है। इनसे पहले के लेखों में हमने आपको मोललता और मोलरता के बारे में विस्तार से बताया था। आप उन्हें भी हमारे इस वेबसाइट से पढ़ सकते हैं।
परीक्षा की दृष्टि से महत्वपूर्ण टॉपिक होने के कारण ही हमेशा अपने आर्टिकल में शामिल किया है। कुछ महत्वपूर्ण प्रश्नों जैसे कि नार्मलता किसे कहते हैं, Normalta Ki Paribhasha, नॉर्मलता को कैसे ज्ञात किया जाता है। इससे संबंधित परीक्षा में पूछे जाने वाले आंकिक प्रश्न, (इन आंकिक प्रश्नो का अभ्यास करते रहे जिससे की आप परीक्षा में ऐसे प्रश्न आसानी से हल कर सकें) आदि को आज हम आपको पूरे विस्तार से बताएंगे। आपको हमारे इस लेख को अंत तक जरूर पढ़ना है ताकि आपको हर एक चीज बारीकी से समझ में आए। तो बिना किसी देर की है चलिए शुरू करते हैं अपना आज का आर्टिकल नॉर्मलता किसे कहते हैं।
नॉर्मलता परिभाषा या नार्मलता किसे कहते हैं?
रसायन विज्ञान में विभिन्न प्रकार के Terms यूज़ किया जाता है सांद्रता को व्यक्त करने के लिए। नॉर्मलता भी उसी प्रकार का एक टर्मिनोलॉजी है जिसकी सहायता से अब किसी विलयन की संद्रता को व्यक्त करते हैं। वैज्ञानिक दृष्टिकोण से नार्मलता की परिभाषा इस प्रकार दी जा सकती है कि किसी विलयन के एकांक आयतन में घुले हुए विलेय के ग्राम या मोल तुल्यांको की संख्या को नॉर्मलता कहते हैं। इसे N से व्यक्त किया जाता है। मूल तुल्यांक का मतलब किसी विलयन में उपस्थित सक्रिय मोलों की संख्या को कहा जाता है जो अभिक्रिया में भाग लेते हैं।
नार्मलता का सूत्र
निम्नलिखित सूत्र का इस्तेमाल करके आप नॉर्मलता को ज्ञात कर सकते हैं –
नार्मलता = ग्राम तुल्यांको की संख्या × [लीटर में घोल की मात्रा]-1

ग्राम तुल्यांकों की संख्या = विलेय का भार × [विलेय का तुल्यांकी भार]-1
N = विलेय का भार (ग्राम) × [equivalent weight × आयतन (L)]
N = मोलरिटी × molar mass × [equivalent द्रव्यमान]-1
N = मोलरिटी × basicity = मोलरिटी × acidity
नार्मलता को अक्सर N से दर्शाया जाता है। नार्मलता की कुछ अन्य units को eq L-1 या meq L-1 के रूप में भी व्यक्त किया जाता है।
नॉर्मलता की गणना कैसे की जाती है?
नॉर्मलता को ज्ञात करने के लिए निम्नलिखित चरणों का पालन करना पड़ता है –
- सर्वप्रथम नॉर्मलता को ज्ञात करने के लिए हमें अभिक्रिया में भाग लेने वाले पदार्थों के तुल्यांकी भार की जानकारी होनी चाहिए
- इतना करने के पश्चात विलय के Gram Equivalent की गणना की जाती है।
- अब हम जिस विलायक का प्रयोग कर रहे हैं उसका आयतन हमें लीटर में रखना है।
- प्राप्त किए गए सभी डेटा को आप उपरोक्त फार्मूले में रखकर नॉर्मलता कि वैल्यू को प्राप्त कर सकते हैं।
अनुमापन करते समय नॉर्मलता की गणना
अनुमापन में किसी एक ज्ञात विलयन की सांद्रता तथा एक अन्य विलयन जिसकी सांद्रता ज्ञात नहीं है, को धीरे-धीरे आपस में मिलाने की प्रक्रिया है और यह प्रक्रिया तब तक करानी है जब तक की उदासीनीकरण की अभिक्रिया ना हो जाए। अनुमापन के सहायता से हम किसी अन्य अज्ञात विलयन की सांद्रता का पता लगा सकते हैं। इसका सूत्र निम्नलिखित है –
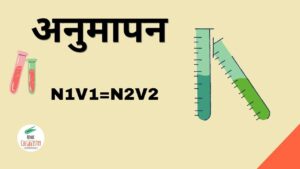
N1V1=N2V2
N1 = अम्लीय Solution की नॉर्मलता
V1 = अम्लीय विलयन का आयतन
N2 = Basic Solution की नॉर्मलता
V3 = Basic विलयन का आयतन
नार्मलता और मोललता में अंतर
अब हम आपको अपने इस लेख नॉर्मलता किसे कहते हैं में मोललता और नॉर्मलता में क्या अंतर है यह बताने जा रहे हैं। यह अंतर निम्न प्रकार है –
- किसी विलयन के एकांक आयतन में घुले हुए विलेय के ग्राम या मोल तुल्यांको की संख्या को नॉर्मलता कहते हैं। इसे N से व्यक्त किया जाता है। जबकि किसी एक किलोग्राम विलायक में खुले हुए विलय के मोलो की संख्या को उस विलयन की मोललता कहते हैं।
- नॉर्मलता का मात्रक N या फिर eq L-1 होती है। वहीं दूसरी ओर मोललता का मात्रक mol/kg होता है।
- नॉर्मलता ताप पर निर्भर करती है परंतु मोललता पर ताप का कोई भी प्रभाव नहीं पड़ता है।
अक्सर पूछे जाने वाले प्रश्न (FAQs)
प्रश्न 1. निम्नलिखित अभिक्रिया में नॉर्मलता की गणना करें और ज्ञात करें जब यह 1.0 M H3PO4 हो
H3AsO4 + 2NaOH → Na2HAsO4 + 2H2O
उत्तर : यदि हम दी गई अभिक्रिया को देखें तो हम पहचान सकते हैं कि H3AsO4 के H+ आयनों में से केवल दो ही NaOH से क्रिया करके product बनाते हैं । इसलिए, दो आयन 2 equivalent हैं। नॉर्मलता ज्ञात करने के लिए हम दिए गए सूत्र का प्रयोग करेंगे।
नार्मलता = ग्राम तुल्यांको की संख्या × [लीटर में घोल की मात्रा] -1
N = 1.0 × 2 (मानों की जगह)
इसलिए, विलयन की नॉर्मलता = 2.0
प्रश्न 2. यदि साइट्रिक अम्ल के 25.00 मिली घोल को 0.1718 N KOH के 28.12 mL से अनुमापित किया जाए तो साइट्रिक अम्ल की सान्द्रता क्या होगी?
उत्तर : Na × Va = Nb × Vb
Na × (25.00 mL) = (0.1718N) (28.12 mL)
इसलिए citric acid की सान्द्रता = 0.1932 N.
प्रश्न 3 . 0.4258 ग्राम KHP (eq. wt = 204.23) के मानकीकरण में यदि 31.87 mL आधार का उपयोग किया जाता है, तो base की नॉर्मलता ज्ञात कीजिए?
उत्तर : 0.4258 ग्राम KHP × (1 eq/204.23g) × (1 eq base/1eq acid): = 2.085 × 10-3 eq base/0.03187 L = 0.6542N base की नॉर्मलता = 0.6542 N है।
प्रश्न 4. निम्नलिखित की नॉर्मलता क्या है? a. 0.1381 M NaOH & b.0.0521 H3PO4
उत्तर : a. N = 0.1381 mol/Lit × (1 eq/1 mol) = 0.1381 eq/Lit = 0.1381 N
b. N = 0.0521 mol/Lit × (3 eq/1 mol) = 0.156 eq/Lit = 0.156 N
निष्कर्ष
विस्तार से चर्चा करने के बाद अब हम जिन प्रश्नों को अच्छे से जान गए हैं अभी कुछ इस प्रकार है कि नार्मलता किसे कहते हैं, Normalta Kya Hai, Normalta Kise Kahte Hain? इसके आगे प्रश्नों को हल करना भी सीख लिया है। लेख पसंद आया हो तो आप इसे शेयर कर सकते हैं। बहुत जल्दी मिलेंगे एक नए लेख के साथ तब तक के लिए धन्यवाद नमस्कार।




