हाइड्रोक्लोरिक अम्ल का सूत्र क्या है इसके उपयोग तथा बनाने की विधि
दोस्तों स्वागत है आपका हमारी हिंदी केमिस्ट्री की वेबसाइट पर। आज के इस आर्टिकल में हम आपको हाइड्रोक्लोरिक अम्ल का सूत्र क्या होता है? हाइड्रोक्लोरिक अम्ल क्या होता है? यह किस प्रकार बनता है? इसे किस नाम से जाना जाता है? इसकी खोज किसने की थी? इसके गुण कौन कौन से होते हैं?इसके बारे में बताएँगे। इसके साथ साथ हम आपको हाइड्रोक्लोरिक अम्ल के उपयोग और बनाने की विधि के बारे में बताएँगे। यह एक बहुत महत्वपूर्ण टॉपिक है जिसके वारे में हम आपको इस आर्टिकल में विस्तार के साथ बताएँगे।
पिछले आर्टिकल में हमने आपको नाइट्रिक अम्ल का सूत्र क्या है? इसके बारे में बताया। जो एक बहुत ही महत्वपूर्ण टॉपिक है इसके बारे में केमिस्ट्री विषय से सम्बंधित सभी स्टूडेंट को पता होना चाहिए इस महत्वपूर्ण टॉपिक की जानकारी आप हमारी हिंदी केमिस्ट्री की वेबसाइट से ले सकते हैं। आज के आर्टिकल में आप हाइड्रोक्लोरिक अम्ल का निर्माण किस विधि के द्वारा होता है? इसके बारे में विस्तार के साथ जानेंगे। परीक्षाओं में हाइड्रोक्लोरिक अम्ल से सम्बंधित प्रश्न कई बार पूछे जा चुके हैं इसलिए इस टॉपिक को ध्यानपूर्वक अंत तक जरूर पढ़े।
हाइड्रोक्लोरिक अम्ल क्या है और हाइड्रोक्लोरिक अम्ल का सूत्र
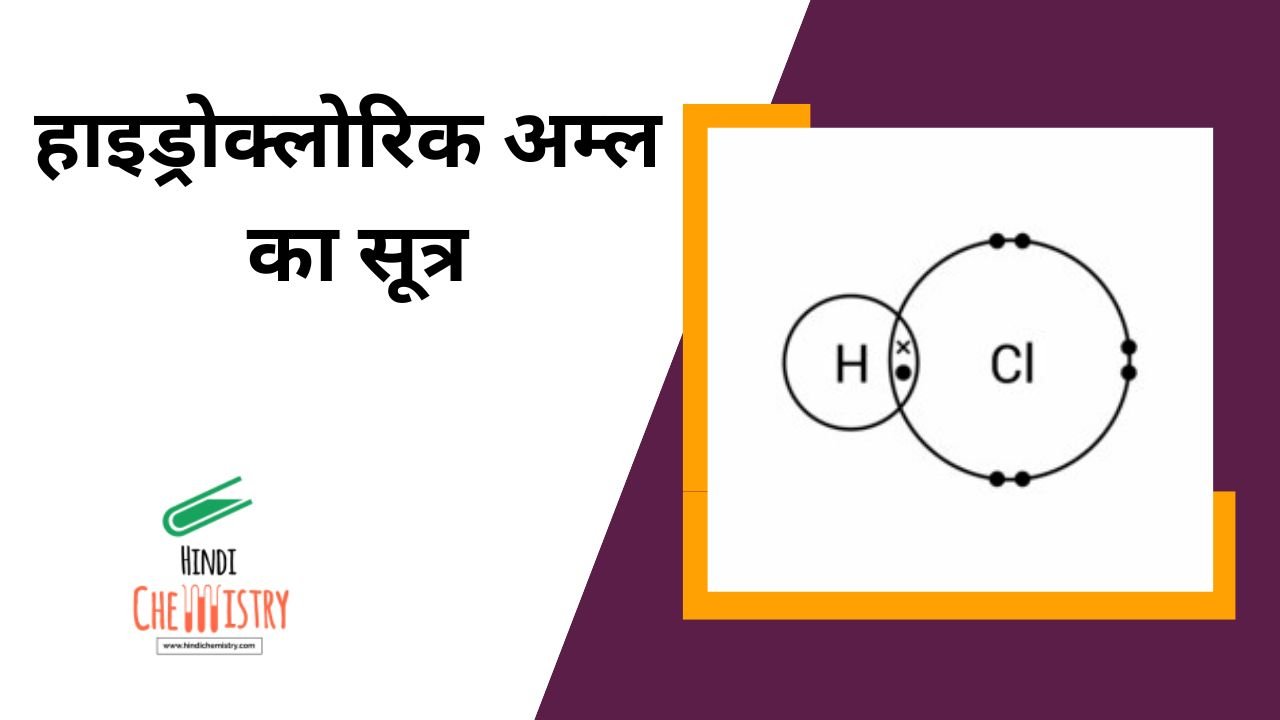
हाइड्रोक्लोरिक अम्ल एक अकार्बनिक यौगिक (Inorganic Compound) होता है। इसका सूत्र HCl होता है इसका नाम हाइड्रोजन क्लोराइड या हाइड्रोक्लोरिक एसिड होता है। ये जो हाइड्रोक्लोरिक अम्ल है यह एक रंगहीन पारदर्शीय पदार्थ होता है। यानि यह कई कलरों में आता है। इसके अन्दर एक इंट्रेस्टिंग फैक्ट ये होता है अगर आप इसे किसी बोतल में करके खुला छोड़ देते हो तो इसमें से धुआ निकलना स्टार्ट हो जाता है। इसे हम कई नामों से पुकारते हैं जैसे कि नमक का स्प्रेट या मयूरीएटिक एसिड या हाइड्रोनियम क्लोराइड या क्लोरोहाइड्रिक एसिड।
हाइड्रोक्लोरिक अम्ल का रासायनिक सूत्र = HCl

हाइड्रोक्लोरिक अम्ल की खोज
हाइड्रोक्लोरिक अम्ल की खोज 1648 में ग्लोबर नामक वैज्ञानिक ने की थी। इन्होने साधारण नमक को सांद्र सल्फ्यूरिक अम्ल के साथ गर्म करके हाइड्रोक्लोरिक अम्ल प्राप्त किया। जोसेफ प्रिस्टली नामक वैज्ञानिक ने 1772 ईसवी में हाइड्रोक्लोरिक अम्ल को तैयार किया। हाइड्रोक्लोरिक अम्ल हम्फ्री डैवी ने 1810 में यह सिद्ध किया कि यह हाइड्रोजन और क्लोराइड का यौगिक होता है।
हाइड्रोक्लोरिक अम्ल ज्वालामुखी की गैसो में पाया जाता है। ये मानव के स्टोमच के अन्दर भी पाया जाता है। जोकि हमारे भोजन को पचाने में बहुत ही सहायता करता है। हाइड्रोक्लोरिक अम्ल काफी खतरनाक होता है। क्योकि अगर आप कोई लोहे की कील इस अम्ल के अन्दर डालते हो तो ये कील विघल जाएगी। अब आप सोच रहे होंगे कि हाइड्रोक्लोरिक अम्ल हमारे स्टोमच में भी पाया जाता है तो ये उसे क्यों हानि नहीं पहुचाता। ये हानि इसलिए नहीं पहुचाता क्योंकि मानुष के शरीर में श्लेष्मा झिल्ली जिसे म्यूकस भी कहते हैं पाई जाती है जो इस हाइड्रोक्लोरिक अम्ल से हमारी रक्षा करती है। जब किसी कारण से पाचन कार्य ठीक से नहीं हो पाता तो हमारे पेट में जलन या ऐठन या दर्द होने लगता है और इसको रोकने के लिए हम एक ट्रीटमेंट देते हैं जिसका नाम है मेंटा एसिड।
HCl बनाने की विधि
प्रयोगशाला में हाइड्रोक्लोरिक अम्ल (Hydrochloric Acid) या हाइड्रोजन क्लोराइड (Hydrogen Chloride) को सोडियम क्लोराइड तथा सांद्र सल्फ्यूरिक अम्ल को एक साथ गर्म करके प्राप्त किया जाता है।
2NaCl + H2SO4 ____गर्म ____> Na2SO4 + 2HCl (हाइड्रोक्लोरिक अम्ल)
जल तथा क्लोरीन की आपस में क्रिया कराने पर हाइड्रोक्लोरिक अम्ल प्राप्त होता है।
2H2O + 2Cl2 ________> 4HCl + O2

हाइड्रोक्लोरिक अम्ल के गुण
- हाइड्रोजन क्लोराइड रंगहीन व तीक्षण गंध वाली गैस है।
- ये जल में आसानी से द्रवित हो जाती है।
- हाइड्रोक्लोरिक अम्ल जल में अत्याधिक विलेय है। इसका जलीय विलयन अम्लीय होता है।
- सूघने पर ये नाक गला तथा फेफड़ो पर जलन उत्पन्न करती है।
- ये वायु से भारी गैस है इसका वाष्प घनत्व 18.25 होता है।
हाइड्रोजन क्लोराइड के रासायनिक गुण
- हाइड्रोजन क्लोराइड अमोनिया से करके अमोनियम क्लोराइड बनाती है।
NH3 + HCl ________> NH4Cl (अमोनियम क्लोराइड)
- हाइड्रोक्लोरिक अम्ल दुर्बल अम्लो के लवणों जैसे कार्बोनेट, बाइकार्बोनेट तथा सल्फाइड आदि को विघटित कर देता है।
2HCl + Na2CO3 __________> 2NaCl + H2O + CO2
HCl + NaHCO3 __________> NaCl + H2O + CO2
2HCl + Na2SO3 _________> 2NaCl + H2O + SO2
- हाइड्रोजन क्लोराइड के 3 भाग तथा नाइट्रिक अम्ल के 1 भाग को मिलाने पर एक्वारेजिया (अम्लराज) बनता है। जो सोने तथा प्लेटिनम जैसी धातुओं को अपने अन्दर घोलने का गुण रखता है।
Au + 3HCl + HNO3 ___________> AuCl3 + NO + 2H2O
Pt + 12HCl + 4HNO3 ___________> 3PtCl4 + 4NO + 8H2O
3PtCl4 + 6HCl ___________> 3Pt(H2Cl6)
- हाइड्रोजन क्लोराइड उच्च ताप 500o C पर हाइड्रोजन तथा क्लोरीन में व्योजित हो जाती है।
2HCl _________> H2 + Cl2
- जो धातुएँ विद्युत रासायनिक श्रेणी में हाइड्रोजन से ऊपर होती हैं वह तनु HCl के साथ क्रिया करके हाइड्रोजन गैस मुक्त करती हैं।
Zn + 2HCl __________> ZnCl2 + H2
2Na + 2HCl __________>2NaCl + H2
- हाइड्रोजन क्लोराइड की धातुओं के ऑक्साइड से क्रिया कराने पर धातुओं के क्लोराइड और जल बनता है।
MgO + 2HCl _________> MgCl2 + H2O
ZnO + 2HCl __________> ZnCl2 + H2O
हाइड्रोक्लोरिक अम्ल के उपयोग
- क्लोरीन, अमोनियम क्लोराइड तथा ग्लूकोज के उत्पादन में इसका उपयोग किया जाता है।
- हाइड्रोक्लोरिक अम्ल का उपयोग प्रयोगशाला में अभिकर्मक के रूप में किया जाता है।
- इसका उपयोग ओषधियों की उत्पादन में किया जाता है।
- इसका उपयोग अस्थियों तथा कोयले के शुद्धिकरण में किया जाता है।
- इसका उपयोग अस्थियों से श्लेष के निष्कर्षण में किया जाता है।
हाइड्रोक्लोरिक अम्ल का परीक्षण
हाइड्रोक्लोरिक अम्ल का परीक्षण हम निम्नलिखित तरीके से कर सकते हैं।
- हाइड्रोक्लोरिक अम्ल अमोनिया के साथ अमोनियम क्लोराइड का सफेद धुआं बनाता है।
- हाइड्रोक्लोरिक अम्ल का जलीय विलयन सिल्वर नाइट्रेट के विलयन के साथ सिल्वर क्लोराइड का सफेद अवक्षेप बनाता है। जो नाइट्रिक अम्ल में अघुलनशील होता है।
निष्कर्ष
आज के आर्टिकल में हमने आपको हाइड्रोक्लोरिक अम्ल का सूत्र क्या होता है? हाइड्रोक्लोरिक अम्ल क्या होता है? यह किस प्रकार बनता है? इसे किस नाम से जाना जाता है? इसकी खोज किसने की थी? इसके गुण कौन कौन से होते हैं?इसके बारे में बताया है। इसके साथ साथ हम आपको हाइड्रोक्लोरिक अम्ल के उपयोग और बनाने की विधि के बारे में बताया है। यह एक बहुत महत्वपूर्ण टॉपिक है जिसके वारे में हमने आपको इस आर्टिकल में विस्तार के साथ बताया है। इसी प्रकार के महत्वपूर्ण आर्टिकल हम अपनी इस वेबसाइट पर देते रहते हैं। इसी प्रकार के नये नये आर्टिकल की जानकारी पाने के लिए जुड़े रहिए हमारी हिंदी केमिस्ट्री की वेबसाइट के साथ तब तक के लिए धन्यवाद।




